星汉德生物公布SCG101 TCR-T细胞治疗最新突破临床数据
星汉德生物(SCG),一家专注于感染及其相关癌症的创新免疫疗法公司,在法国巴黎举行的国际细胞与基因治疗大会(ISCT) Late-breaking临床试验报告会议上,公布其乙肝抗原特异性T细胞受体(TCR) T细胞疗法(研发代号:SCG101)的最新突破临床数据。
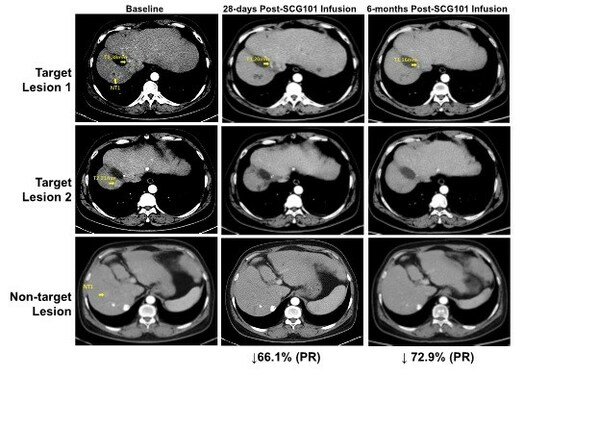
临床数据显示,SCG101具有显著的抗肿瘤和抗病毒活性,一名患有乙型肝炎病毒(HBV)相关肝细胞癌(HCC)患者接受单剂SCG101输注后,第28天肿瘤靶病灶相比基线缩小66%,达到部分缓解(PR),并在第4个月进一步缩小74.5%;另一处病灶完全消失。试验期间患者没有接受任何其他抗肿瘤治疗。数据截止时,肿瘤已保持超过6.9个月没有进展,保持持续缓解状态。
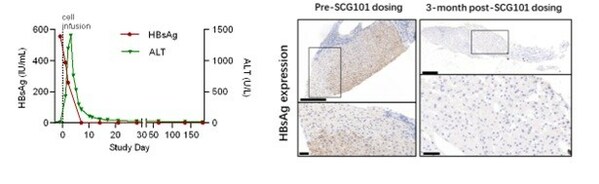
基于回输前后的肝脏免疫组化分析显示,乙肝表面抗原阳性肝细胞实现100% 清除,HBV血清学标志HBsAg从SCG101输注前的557.96 IU/mL,在输注后第7天降至1.3 IU/mL,第28天进一步降至0.08 IU/mL。
肝癌是全球第六大常见癌症, 每年新发病例超过90万。乙型肝炎病毒感染是导致肝癌的主要原因,乙肝病毒相关肝细胞癌占中国肝癌病例超过80%。乙肝病毒感染后,病毒DNA会整合进宿主基因组,可导致宿主细胞基因组不稳定性,表达病毒相关致癌基因,并诱发炎症、氧化应激等反应,引起肝细胞异常再生,最终多种机制共同导致肝细胞癌。
SCG101是一种乙肝抗原特异性的TCR-T细胞疗法,可以特异性靶向HBV抗原相关T细胞表位,有效清除HBV-HCC肿瘤细胞、HBV-DNA整合的癌前病变细胞和HBV感染细胞。
星汉德生物首席科学官张柯博士表示:"肿瘤微环境是限制肿瘤免疫治疗疗效的关键屏障。通过靶向和清除肿瘤组织周边HBsAg阳性肝细胞及HBV整合的癌前病变细胞,可显著促进SCG101 TCR-T细胞在进入肿瘤微环境之前充分激活和扩增,并通过分泌多重细胞因子调节肝脏固有的免疫抑制微环境,增强T细胞肿瘤浸润,进而打破免疫耐受、诱发内源性抗肿瘤免疫反应。SCG101的这种独特机制可以有效地克服T细胞治疗在实体瘤中所面临的一类共同挑战。"
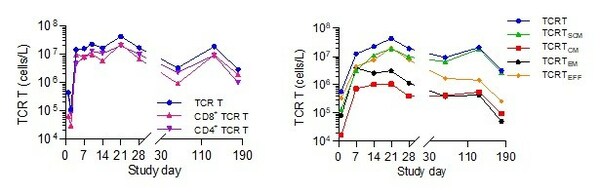
张柯博士补充说:"在免疫相关生物标志物分析中,SCG101显示出独特的CD8/CD4 双重T细胞功能活性。SCG101输注后,患者体内TCR-T细胞显著扩增,表现出良好的CD8+:CD4+ TCR-T比例平衡,有助于强化T细胞相互作用辅助扩增,提升抗肿瘤反应。同时,观察到高比例的干细胞样记忆性T细胞(Stem cell-like memory T cell,Tscm)扩增及长期续存,形成特异性记忆T细胞亚群,实现SCG101长期自我更新能力和功能性,维持持续的抗肿瘤和抗病毒效应。"
星汉德生物首席执行官王树立表示:"SCG101所表现出有效而持久的抗肿瘤和抗病毒功能为患者带来了巨大获益,这非常令人振奋,我们期待开发出更多的TCR-T细胞治疗产品在攻克实体瘤的进程中发挥更大作用,为更多患者带来获益。"
关于SCG101
SCG101是一种针对乙型肝炎表面抗原特异性的自体T细胞受体(TCR) T细胞疗法。星汉德生物利用自主研发的独有GianTTM技术平台,筛选高亲力且高结合力的天然TCR,可以有效靶向实体肿瘤中通过主要组织相容性复合体(MHC)表达的细胞内抗原。临床前和临床研究数据显示,SCG101具有肿瘤抑制和HBV cccDNA根除作用,可实现抗肿瘤和抗病毒功能。SCG101已获美国食品药品监督管理局(FDA)、中国国家药品监督管理局(NMPA)、新加坡卫生科学管理局(HSA) 和香港卫生署(DOH)批准用于乙肝感染相关肝癌的临床试验。
关于肝细胞癌
肝细胞癌是最常见的肝癌类型,据估计,全球每年有超过90万例肝癌新发病例,为全球癌症死亡的主要原因之一。乙型肝炎病毒感染是导致肝癌的主要原因,在中国占肝细胞癌病例的超过80%。肝癌发现的时候一般都是晚期,生存时间短、病死率高,5年生存率不足15%。
关于星汉德生物
星汉德生物是一家领先的生物技术公司,专注于开发感染及其相关癌症的新型免疫疗法。公司针对最常见的致癌感染:幽门螺杆菌、人乳头瘤病毒和乙型肝炎,开发广泛而独特的TCR-T细胞疗法、双特异抗体和治疗性疫苗,实现预防和治愈感染和其相关的癌症的目标。星汉德生物总部位于新加坡,结合新加坡、中国和德国的区域优势,涵盖从创新药物研发、生产、临床试验和商业化的完整产业价值链。
上一篇:没有了
栏 目:临床实验
下一篇:和铂医药于2023年ASCO大会公布Porustobart联合特瑞普利单抗治疗肝细胞癌的Ib期临床试验结果
本文标题:星汉德生物公布SCG101 TCR-T细胞治疗最新突破临床数据
本文地址:
您可能感兴趣的文章
- 05-29美敦力与唯医骨科达成战略合作
- 03-29辉瑞新一代口服JAK1抑制剂abrocitinib 3期临床结果公布
- 05-05信达超2亿美元引进的下一代PDE4抑制剂在国内申报临床
- 03-14阿斯利康PD-1/TIGIT双特异性抗体在中国申报临床
- 08-25君实生物JS110(XPO1抑制剂)临床试验申请获得美国FDA批准
- 09-13获FDA快速通道资格 创新吸入式抗生素疗法达到3期临床终点
- 08-25佐利替尼治疗NSCLC伴CNS转移国际多中心二/三期临床研究完成最后一例受试者末次访视
- 03-29复宏汉霖创新型抗PD-1单抗MSI-H实体瘤即将递交上市申请,2期临床研究达到主要终点
- 11-08歌礼与苏州康宁杰瑞签署ASC22(恩沃利单抗)治疗乙型肝炎及其他病毒性疾病的全球独家开发协议
- 09-05信达生物宣布mazdutide(IBI362)在中国肥胖受试者中的II期临床研究高剂量队列完成首例受试者给药
阅读排行
推荐教程
- 10-30奥泰医疗并入先导科技集团,打造高端医疗影像全产业链
- 10-30药明康德2023年前三季度业绩稳健增长
- 09-18新型药物可阻止器官移植中的关键衰老机制
- 09-11迪哲医药全球首款T细胞淋巴瘤JAK1抑制剂戈利昔替尼研究成果刊于《肿瘤学年鉴》,影响因子高达51.8
- 09-11阿斯利康在2023欧洲呼吸学会(ERS)的临床研究数据表明,其在呼吸系统疾病治疗转型为吸入剂和生物制剂综合治疗的过程中处于领导性地位
- 09-11宁科生物实控人被立案,屡次转型却连年亏损…
- 09-06医疗康复:脑机接口产业化第一站
- 07-05一种水螅为衰老和再生提供新见解
- 07-05运动数据有助提早发现帕金森病
- 07-05一种水凝胶可再生子宫内膜,有望治疗不孕不育症






