2021第一季度超30款新药在中国获批 含4款新冠疫苗
2021年第一季度刚刚结束。根据中国国家药监局(NMPA)发布的药品批准证明文件,截止3月31日(以签发日期计算),第一季度有27款新药在中国获批上市(包含新适应症),惠及非小细胞肺癌(NSCLC)、乳腺癌、系统性红斑狼疮(SLE)、X连锁低磷血症(XLH)等多种病患。其中获得NMPA“官宣”获批的新药有5款,中国国产1类新药有7款。此外还有4款新冠疫苗获批附条件上市或紧急使用,包括灭活疫苗、腺病毒载体疫苗和重组亚单位疫苗。本文将带大家看下第一季度获批的创新产品有哪些亮点。
亮点一:5款“官宣”,重大新药在中国加速获批
据统计,在2020年里被NMPA“官宣”批准上市的创新药有14款。而这一数字仅在今年第一季度就达到了5款,这可能是重大新药在中国获批速度和数量继续保持的一个趋势。通常荣获NMPA“官宣”批准的药品,大多数会获得CDE优先审评,且对中国生物医药领域和患者都有重要意义,如临床急需新药等。
这5款“官宣”药品分别是:1)Kyowa Kirin公司FGF23靶向疗法布罗索尤单抗注射液,用于成人和1岁及以上儿童患者X连锁低磷血症的治疗;2)艾力斯医药第三代EGFR-TKI甲磺酸伏美替尼片,用于局部晚期或转移性NSCLC成人患者的治疗;3)荣昌生物全新作用机制的注射用泰它西普,用于系统性红斑狼疮成年患者;4)华昊中天药业1类新药优替德隆注射液,用于既往接受过至少一种化疗方案的复发或转移性乳腺癌患者;5)基石药业RET抑制剂普拉替尼胶囊,用于RET基因融合阳性的局部晚期或转移性NSCLC成人患者的治疗。
2021第一季度NMPA“官宣”新药
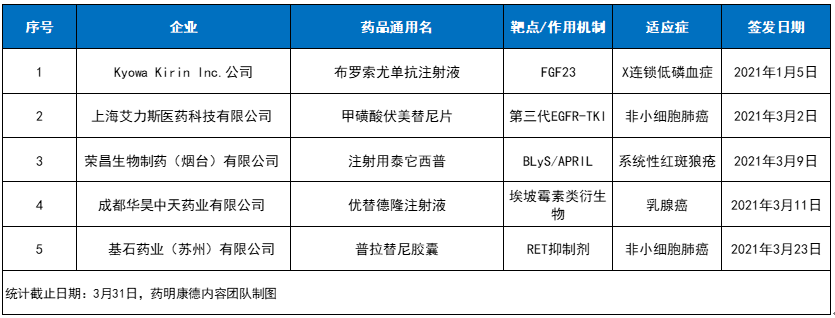
值得一提的是,这5款新药中除了优替德隆注射液,其它4款均为通过优先审评审批程序附条件批准的新药。根据NMPA相关指导原则,获得附条件批准的药品,一般为治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,且药物临床试验已有数据显示疗效并能预测其临床价值。附条件批准上市的应用,大大缩短了药物临床试验的研发时间,并让许多无法继续等待的危重疾病或临床急需的患者尽早能够获得新的治疗选择。
亮点二:多款产品创下了“中国首个”的记录
在第一季度获批的新药中,有多款产品创下了“中国首个”的记录。备受关注的例如,基石药业普拉替尼是中国首个获批的RET抑制剂;华昊中天药业的1类新药优替德隆注射液是首个埃博霉素类抗肿瘤药物;荣昌生物泰它西普是60多年来首款在中国获批上市的治疗系统性红斑狼疮的中国国产新药;优时比(UCB)拉考沙胺片是中国市场11年来首个获批的第三代新型抗癫痫药物;基石药业阿伐替尼是首个在中国获批用于PDGFRA外显子18突变胃肠道间质瘤(GIST)的治疗药物;再鼎医药瑞派替尼是在中国大陆首个获批上市用于全人群GIST四线治疗的创新药物等。
此外,这一季度还有3款中国国产抗PD-1抗体陆续收获新适应症,包括百济神州替雷利珠单抗(鳞状NSCLC)、信达生物信迪利单抗(非鳞状NSCLC)、君实生物特瑞普利单抗(复发/转移性鼻咽癌)。加上恒瑞医药的卡瑞利珠单抗,截至目前中国国产抗PD-1抗体在中国已获批黑色素瘤、鼻咽癌、非小细胞肺癌、经典型霍奇金淋巴瘤、肝细胞癌、尿路上皮癌、食管鳞癌等七大癌种,为许多癌症患者带来了新的治疗选择。
2021第一季度NMPA批准的中国国产1类新药(含新适应症)
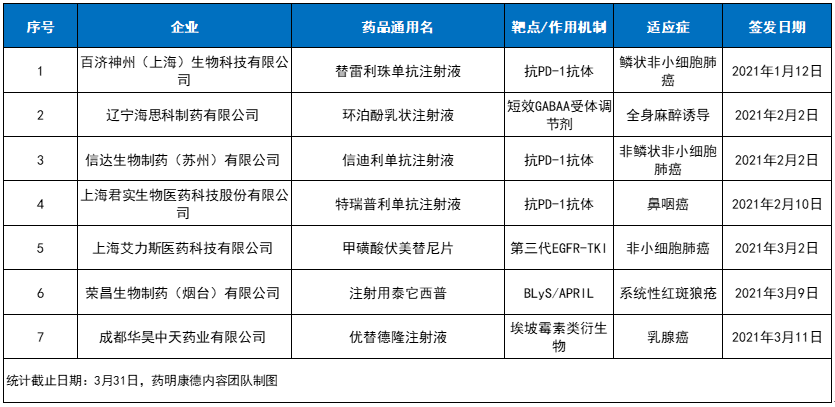
总体来看,第一季度有7款中国国产1类新药获得NMPA批准上市,这表明中国生物医药领域的创新能力正持续转化为造福患者的成果。
亮点三:4款新冠疫苗获批附条件上市或紧急使用
新冠疫情爆发一年多以来,在社会各界的团结协作下,中国新冠病毒疫苗的研发和生产已经取得了重要进展。根据NMPA政府公开信息,中国已有4款疫苗附条件上市、1个疫苗获准紧急使用,且产能产量大幅提升。目前,中国正在加快推进新冠病毒疫苗接种工作,提高人群接种率,从而有效降低新冠病毒传播风险。
值得一提的是,这5款疫苗中有4款为今年第一季度获得批准附条件上市或紧急使用。从疫苗的种类来看,既有灭活疫苗、腺病毒载体疫苗,还有重组亚单位疫苗。这些附条件上市的疫苗均已在3期临床试验期中显示出良好的疫苗保护效力。
2021第一季度NMPA批准的新冠疫苗(含紧急使用)
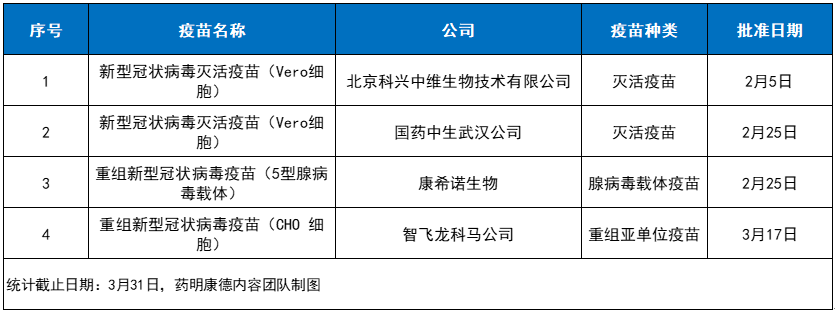
其中,来自科兴中维和国药集团中国生物武汉生物制品研究所公司的新型冠状病毒灭活疫苗(Vero细胞)均为灭活疫苗,其原理是使用非洲绿猴肾(Vero)细胞进行病毒培养扩增,经β丙内酯灭活病毒,保留抗原成分以诱导机体产生免疫应答,并加用氢氧化铝佐剂以提高免疫原性。
康希诺生物的重组新型冠状病毒疫苗为腺病毒载体疫苗,其原理是将新冠病毒的刺突糖蛋白(S蛋白)基因重组到复制缺陷型的人5型腺病毒基因内,基因重组腺病毒在体内表达新冠病毒S蛋白抗原,诱导机体产生免疫应答。
获批紧急使用的是由智飞龙科马公司生产的重组新冠病毒疫苗(CHO细胞),这是一款重组亚单位疫苗,其原理是将新冠病毒S蛋白受体结合区(RBD)基因重组到中国仓鼠卵巢(CHO)细胞基因内,在体外表达形成RBD二聚体,并加用氢氧化铝佐剂以提高免疫原性。该疫苗在2期临床试验中显示具有良好的免疫原性和安全性。
我们祝贺这些新药在中国获批上市,或获批新适应症。希望它们的到来,可以造福更多患者!
本文来源:药明康德
您可能感兴趣的文章
- 02-21诺华山德士推出Revlimid仿制版本 BMS原研药面临冲击!
- 03-03复星医药旗下公司复星凯特FKC889获药品临床试验批准
- 06-14信达生物宣布其自主研发的托莱西单抗注射液(PCSK-9抑制剂)的新药上市申请获国家药品监督管理局正式受理
- 04-06艾森医疗加入美国上市企业索伦托医疗(SRNE)公司
- 05-29新一代高选择性 BTK 抑制剂康可期在中国上市
- 10-25大型临床研究证中大肠道微生态配方(SIM01)能减新冠及其他细菌和病毒感染风险
- 04-262021年中国Biotech研发投入TOP10 谁能熬过寒冬?
- 03-29三菱田边制药CD19单抗药物Uplizna在日本获批
- 03-10德琪医药宣布澳大利亚药品管理局批准XPOVIO®上市
- 03-28CAN106注射液在中国Ⅰb/ⅠⅠ期临床试验完成首例PNH患者给药
阅读排行
推荐教程
- 10-30奥泰医疗并入先导科技集团,打造高端医疗影像全产业链
- 10-30药明康德2023年前三季度业绩稳健增长
- 09-18新型药物可阻止器官移植中的关键衰老机制
- 09-11迪哲医药全球首款T细胞淋巴瘤JAK1抑制剂戈利昔替尼研究成果刊于《肿瘤学年鉴》,影响因子高达51.8
- 09-11阿斯利康在2023欧洲呼吸学会(ERS)的临床研究数据表明,其在呼吸系统疾病治疗转型为吸入剂和生物制剂综合治疗的过程中处于领导性地位
- 09-11宁科生物实控人被立案,屡次转型却连年亏损…
- 09-06医疗康复:脑机接口产业化第一站
- 07-05一种水螅为衰老和再生提供新见解
- 07-05运动数据有助提早发现帕金森病
- 07-05一种水凝胶可再生子宫内膜,有望治疗不孕不育症






