和誉医药口服PD-L1抑制剂获批临床
3月30日,中国国家药监局药品审评中心(CDE)官网公示,和誉医药申报的ABSK043胶囊获得临床试验默示许可,拟定适应症为恶性肿瘤。公开资料显示,ABSK043为和誉医药研发的创新口服小分子PD-L1抑制剂。该药的临床前研究结果还将在2022年美国癌症研究协会(AACR)年会上展示。
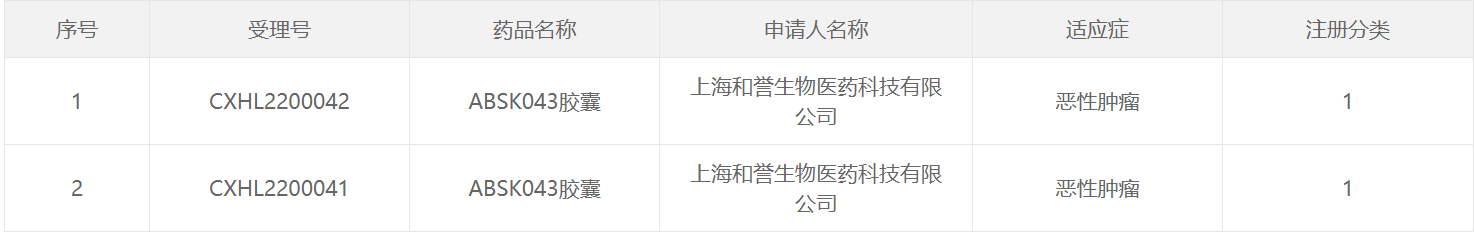
截图来源:CDE官网
在肿瘤免疫治疗领域,小分子PD-1/PD-L1抑制剂的研发逐渐吸引关注。相较于单克隆抗体,小分子PD-1/PD-L1抑制剂具有许多潜在优势,例如:口服给药可改善患者的依从性;小分子相对于抗体半衰期较短,使得与免疫相关的不良反应可以得到更好地控制;小分子的灵活性在接下来的联合疗法中可以更加便捷有效。
据和誉医药早先新闻稿介绍,ABSK043为一款全新具备较好活性、选择性的小分子PD-L1抑制剂。它可与PD-L1特异性结合并诱导其从细胞表面内吞,有效抑制PD-1/PD-L1的相互作用,恢复PD-L1介导的T细胞活化抑制。在多个临床前模型中,ABSK043展现出与已获批抗PD-L1抗体相当的抗肿瘤功效。此外,和誉医药还将探索这款口服小分子PD-L1抑制剂与其他药物的联合治疗潜力。
图片
2021年8月,和誉医药已于澳大利亚完成ABSK043的1期临床试验的首例患者给药。该试验旨在评估其治疗实体瘤的安全性、耐受性、药代动力学及初步抗肿瘤疗效。本次该药在中国获批临床,意味着它即将在中国开展临床研究。
参考资料:
[1] 中国国家药监局药品审评中心(CDE)官网.Rereieved Mar 30,2022.From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2] 和誉医药口服PD-L1抑制剂ABSK043临床试验许可申请获得NMPA受理.Rereieved Jan 24,2022.From https://mp.weixin.qq.com/s/gDUkHIT2yO4Z2-af-7XpAA
[3] 和誉医药宣布确定两款新一代创新抗肿瘤候选药物,并将在2022年AACR年会上展示多项药物发现及转化医学研究成果.Rereieved Jan 24,2022.From https://mp.weixin.qq.com/s/14Xr-51DMykqZx3l7B4xHg
上一篇:1亿美元助力开发精准帕金森病疗法 主打药物今年进入临床开发
栏 目:临床实验
下一篇:近四成患者可恢复80%头发生长!礼来JAK抑制剂52周长期疗效积极
本文标题:和誉医药口服PD-L1抑制剂获批临床
本文地址:
您可能感兴趣的文章
- 09-05信达生物宣布mazdutide(IBI362)在中国肥胖受试者中的II期临床研究高剂量队列完成首例受试者给药
- 05-05信达超2亿美元引进的下一代PDE4抑制剂在国内申报临床
- 03-10治疗三阴性乳腺癌 默沙东Keytruda遭英国NICE拒绝批准
- 11-08信达生物在《Nature Communications》上发表 IBI319(PD-1/CD137双特异性抗体)的临床前研究结果
- 03-21Sirnaomics 将于第四届RNAi疗法年度峰会上分享其RNAi创新药在肿瘤治疗临床试验的最新进展
- 03-14阿斯利康PD-1/TIGIT双特异性抗体在中国申报临床
- 06-07诺诚健华多项肿瘤管线最新数据在2022年美国ASCO年会上公布
- 05-30MedAlliance旗下DEB获FDA批准
- 01-03基石药业宣布择捷美(R)(舒格利单抗注射液)一线治疗食管鳞癌的注册性临床研究达到主要终点,拟递交新适应症上市申请
- 12-21Carrick和美纳里尼宣布临床试验合作
阅读排行
推荐教程
- 10-30奥泰医疗并入先导科技集团,打造高端医疗影像全产业链
- 10-30药明康德2023年前三季度业绩稳健增长
- 09-18新型药物可阻止器官移植中的关键衰老机制
- 09-11迪哲医药全球首款T细胞淋巴瘤JAK1抑制剂戈利昔替尼研究成果刊于《肿瘤学年鉴》,影响因子高达51.8
- 09-11阿斯利康在2023欧洲呼吸学会(ERS)的临床研究数据表明,其在呼吸系统疾病治疗转型为吸入剂和生物制剂综合治疗的过程中处于领导性地位
- 09-11宁科生物实控人被立案,屡次转型却连年亏损…
- 09-06医疗康复:脑机接口产业化第一站
- 07-05一种水螅为衰老和再生提供新见解
- 07-05运动数据有助提早发现帕金森病
- 07-05一种水凝胶可再生子宫内膜,有望治疗不孕不育症






